レーザーキャプチャーマイクロダイセクション(LCM)は組織内の細胞を直接顕微鏡で観察しながら細胞集団を単離する方法です。LCM技術は、目的の細胞の直接採取や、不要な細胞を切り取って特定の細胞を分離し、組織学的に高純度な細胞集団を取得します。ジェノタイピング、LOH分析、RNAトランスクリプトーム解析、cDNAライブラリー作成、ディスカバリープロテオミクス、シグナル伝達経路プロファイリングなど、様々なダウンストリームアプリケーションに最適です。
レーザーマイクロダイセクションによる植物組織切片を用いたオーキシン分析
- 背景
- 結果
- 結論
植物組織中のオーキシン濃度の定量的な計測は、オーキシン関連遺伝子の発現を測定する分子的な方法を補完するものです。現在、検出限界を押し上げ、ピクトグラム(pg)レベルで日常的にオーキシンを定量できるようになっています。従来と比較して、この種の研究に必要な組織の量は少なくなっています。これと並行して、レーザーマイクロダイセクション顕微鏡(LMD)などの技術が開発され、隣接する細胞を含まずに個別の組織から特定の細胞を採取できるようになりました。近年、特にトランスクリプトームのプロファイリングにおいて、より高い空間分解能を実現するために人気を博しています。しかし、ホルモンを含む他の定量的な測定と同様に、従来のLMDを用いたサンプリングは、サンプルの前処理によって分析対象物の保存が損なわれるため、依然として困難とされています。そこで私たちは、レーザーマイクロダイセクション顕微鏡を用いて、凍結融解、凍結乾燥、キャプチャーを組み合わせたサンプル調製法を開発し、検証しました。これにより、超高感度で空間分解されたオーキシン定量に適した、高品質で保存性の高い植物材料を得ることに成功しました。
私たちは、オーキシンの分解を防ぐために植物組織を最良の状態で保存しながら、インドール-3-酢酸(IAA)定量用の個別の植物組織を提供する凍結抽出、フリーズドライ、LMDを組み合わせた新しい方法を開発しました。このプロトコルは、生物学的化合物の分解が問題となるような、組織特異性の高い低分子分析を必要とする他のアプリケーションにも使用できます。LMDを用いて約4時間で15mg相当の非常に特異的な組織を採取することができました。
私たちは、植物組織の凍結乾燥したクライオセクションがLMDに適しており、GC-MS/MSを用いて植物ホルモンであるオーキシンを定量できることを概念的に示しました。オーキシンレベルを空間的にも時間的にも高精度で解析できるようになれば、複雑なプロセスの実験が可能になり、植物の成長におけるオーキシン(やがては他の植物ホルモンも)のさまざまな役割についての知識が深まると期待しています。
Auxin analysis using laser microdissected plant tissues sections, 2018
パラフィン包埋ヒト腎生検サンプルからマイクロダイセクションの糸球体タフトによるmRNA解析のすすめ
- 背景
- 結果
- 結論
糸球体は、レーザーマイクロダイセクションに適した自然の構造物です。ホルマリン固定パラフィン包埋腎生検の糸球体遺伝子発現解析は、研究用途を向上させる可能性があります。このような研究の主な課題は、糸球体のコンパートメントの分析に適用するため、少量の出発材料から良質のRNAを取得することです。本研究では、糸球体mRNA解析の最適化されたワークフローのためのデータと推奨事項を提供します。
次世代のマイクロダイセクションシステムで提供される適切な解像度のカメラとスクリーンにより、糸球体タフトから壁側上皮細胞を分離することができました。選択されたコンパートメント固有の転写物(糸球体房のWT1とGLEPP1、および壁側上皮細胞のPAX2)は、微小解剖された糸球体下部構造の信頼できる識別因子です。フェノール・クロロホルムで抽出し、ヘマラウンで染色した切片(2 µm)を用いると、多量のボーマン被膜切片(300個以上)から、さらなる分析に十分なRNA濃度(300 ng mRNA以上)が得られました。比較するため、先述した60個の糸球体の切片のうちの多数の染色されていないセクションにおいて、適切なmRNA純度[A260/A280比が1.5(1.4/1.7)中央値(25/75%iles)]の最低量157ngのmRNAがcDNAに逆転写されました。インプットRNA(20、60、150、300個の微小解剖した糸球体切片)の影響を比較すると、60個と150個のレーザー微小解剖した糸球体切片を解析に用いた場合、POLR2Aの転写発現は有意に相関していました。ADAMTS13については、少なくとも60個の糸球体切片を使用した場合に、アッセイ間の変動係数が低くなりました。geNormPlusとNormFinderのアルゴリズムによると、PGK1とPPIAは、GUSB、GAPDH、POLR2A、RPLPO、TBP、B2M、ACTB、18SrRNA、HMBSと比較して、より安定した糸球体転写産物であることがわかりました。
我々のアプローチは、比較対象となる糸球体のmRNA発現解析を研究用途に導入するもので、壁側上皮細胞のような糸球体の下部構造についても同様です。再現性のある結果を得るためには、十分なインプットmRNAを得るために、少なくとも60個の微小解剖した未染色の糸球体または300個のヘマラウン染色したボーマン被膜の切片を使用が推奨されます。また、60個の微小解剖糸球体のRNA濃度の範囲は低く、当社が提案する転写産物(PGK1およびPPIA)を用いてCq値を適切に正規化することで、RNAの純度や量の違いを補正することができます。
乳癌のHER2ステータスを正確に決定:レーザーキャプチャーマイクロダイセクションと定量逆転写ポリメラーゼ連鎖反応のコンビナトリアル法
- 背景
- 方法
- 結果
- 結論
乳がんにおけるHER2の発現は、転移性の増加、腫瘍の再発率の上昇、標的療法への反応性の改善と相関しています。蛍光in situハイブリダイゼーション法(FISH)と免疫組織化学(IHC)は、臨床でHER2の分析によく用いられる2つの方法です。これらは、標準化されていないこと、技術的なばらつき、主観的な解釈などが、大きな問題となっています。
ここでは、乳がんのHER2検査における定量逆転写ポリメラーゼ連鎖反応(RT-qPCR)の適用性を評価しました。ホルムアルデヒド固定パラフィン包埋の腫瘍サンプル30個をRT-qPCR、FISH、IHCで検査し、3つの方法のデータを分析・比較しました。
RT-qPCRでHER2の発現を正確に判定するためには、レーザーキャプチャーマイクロダイセクションが不可欠です。全腫瘍組織からRNAを分離した場合、かなりの数の偽陰性結果が得られました。しかし、精製された癌細胞からのRNAを使用した場合、RT-qPCRデータはFISHおよびIHCと完全に一致しました。さらに、HER3とHER4の発現の違いによって、乳管癌がさらに分類される可能性がある証拠も取得しました。
レーザーキャプチャーマイクロダイセクションとRT-qPCRの組み合わせは、HER2検査において正確で費用対効果の高い診断方法です。このPCR法は、シンプルで正確かつ堅牢のため、臨床検査室で容易に導入・標準化できます。
シオミドロにおけるレーザーキャプチャーマイクロダイセクション:褐藻類における細胞特異的トランスクリプトーム解析への道筋
レーザーキャプチャーマイクロダイセクション(LCM)は、組織切片から個々の細胞を容易に分離することができます。遺伝子増幅技術と組み合わせることで、特定の細胞におけるゲノムワイドな発現プロファイルを調べることが可能な極めて強力な方法です。LCMは、動物と植物の両方で様々な生物学的問題を解決するために広く使用されていますが、LCM技術をマクロ藻類に移植する試みはこれまで行われていませんでした。マクロ藻類は、淡水や海洋に広く生息する真核生物の集合体です。本研究では、褐藻類シオミドロの発生過程を調べるために、LCMと細胞特異的なトランスクリプトームを用いることが可能であることを示しました。スライドグラス上での藻類の培養と固定、レーザーマイクロダイセクション、遺伝子増幅技術を含むワークフローを説明します。この手順の有効性を示すために、シオミドロの直立および伏せたフィラメントの両方から生成された細胞特異的なトランスクリプトームから得られたqPCRデータと測定値を示します。
Laser capture microdissection in Ectocarpus siliculosus: the pathway to cell-specific transcriptomics in brown algae, 2015
ラットの脳虚血後の運動回復および脳の可塑性:強制的な腕のトレーニングの可能性
- 背景&目的
- 方法
- 結果
- 結論
脳卒中後の回復を促進するためには、被患者の腕を固定して理学療法を行う方法(forced arm use, FAU)と、環境を整えて自発的に運動を行う方法(voluntary exercise, VE)の両方が有望です。しかし、脳卒中後の様々なリハビリテーション・トレーニング後の長期的な可塑性の変化に関わるゲノム・メカニズムについては、ほとんど解明されていません。本研究では、実験的虚血後の行動回復と再生の分子マーカーに対するこれらの物理療法の効果を調べました。
Wistar系ラット42匹を対象にPhotothromboticによる感覚運動野の梗塞後48時間から10日間、強制的な腕の使用(FAU,8/10日目に患部以外の肢に1スリーブの石膏ギプスを装着)、自発的な運動(VE,自由にアクセスできるランニングホイールをケージに接続)、またはランニングホイールを使用しないコントロールのいずれかを無作為に行いました。機能的転帰は、虚血前、虚血後、10日間のトレーニング期間後、虚血後3週間および4週間に感覚運動テストを用いて測定しました。虚血前、虚血後、10日間のトレーニング後、虚血後3週間、4週間後にセンサー運動テストを行い、全体的な遺伝子発現の変化を大脳皮質と海馬で評価しました。
FAUを投与した動物は、VEを投与したグループと比較して機能回復が著しく向上し、どちらもケージコントロールよりも優れていました。双方のトレーニングにより、一側および対側の大脳皮質/海馬において、多数の遺伝子が変化しました。全体として、観察された変化の程度は、得られた機能回復と相関していました。遺伝子セットに多く含まれる遺伝子のカテゴリーは、神経可塑性プロセスに関連するもので、NMDA 2a受容体、PKC ζ、NTRK2、MAP 1bなどのマーカー遺伝子が含まれます。
我々は、Photothrombotic後の身体トレーニングが、脳卒中後の機能回復を有意かつ永続的に改善することを示し、強制的な腕のトレーニングが自発的なランニングのトレーニングよりも明らかに優れていることを示した。このような行動上の成果は、調べたすべての脳領域における遺伝子発現の変化のパターンや程度と相関しているます。我々は、身体トレーニングが脳のいくつかの領域で可塑性に関連した遺伝子発現の基本的な変化を誘発し、回復プロセスを可能にすることを提案します。これらの結果は、最適なリハビリテーションの議論に貢献するとともに、将来の薬理学的な回復促進のための貴重な情報を提供します。
マウス真皮脂肪層の形成は皮下脂肪組織とは独立して行われており、FABP4の初期発現が制限されていることの解明
実験用マウスは、脂肪の生物学、代謝、および疾患の研究において重要な動物モデルですが、マウスの皮膚の脂肪層となる組織や細胞に起こる発生上の変化は、ほとんど注目されていません。また、皮膚内の脂肪組織と、皮下脂肪との区別がつかないことが多く、脂肪体をめぐる用語が混乱しています。ここでは、マウス背側の皮膚における脂肪細胞の発達を、出生前から第1毛包成長サイクルの終わりまで調べました。Oil Red O染色、免疫組織学、定量的RT-PCR、TUNEL染色を用いて、毛包の発達と脂肪生成のプロセスが時空間的に密接に関連している観察結果を確認しました。これまでの研究とは異なり、皮膚の脂肪層は真皮下層の細胞から作られることが確認されました。胚発生16日目(e16)には、真皮下層が真皮上層と区別されるようになり、真皮下層における脂肪細胞分化のコミットメントは、脂肪細胞分化のマーカーであるFABP4の発現によって示されました。成熟したマウスでは、皮膚の脂肪層は皮下の脂肪組織と皮幹筋で隔てられています。我々は、どの発育時点においても、皮膚脂肪組織が皮下脂肪組織と結合や混ざり合うことが無いことを確認しました。e14.5マウスから分離した皮膚(脂肪形成開始前)を、成体マウスの腎臓カプセル下に移植することで、皮膚脂肪組織は皮下脂肪の影響を受けずに独立して発達することを示しました。この研究により、毛包と皮膚脂肪細胞の生物学的な発達上のつながりが強化されました。我々は、皮膚脂肪細胞が皮下脂肪組織とは独立して真皮内の細胞から発生することから、正確には真皮脂肪組織と呼ばれ、少なくとも実験用マウスでは、独立した脂肪貯蔵庫を表していると主張します。
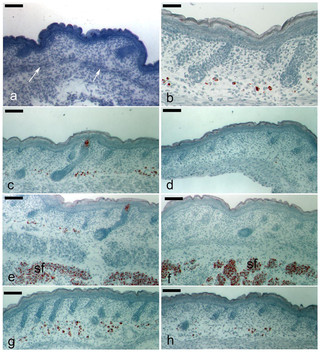
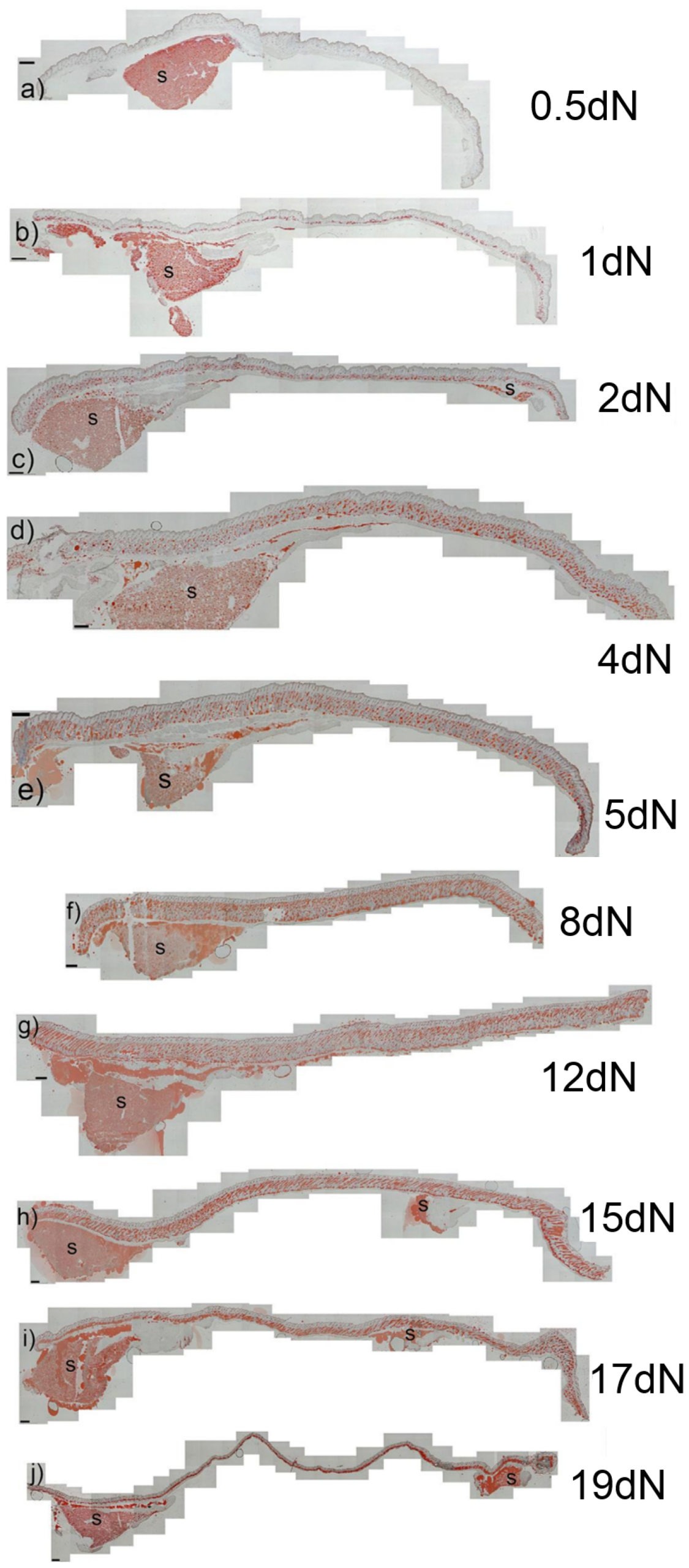
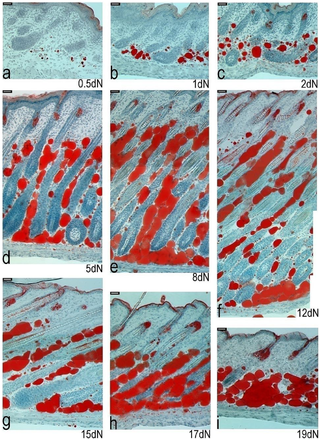
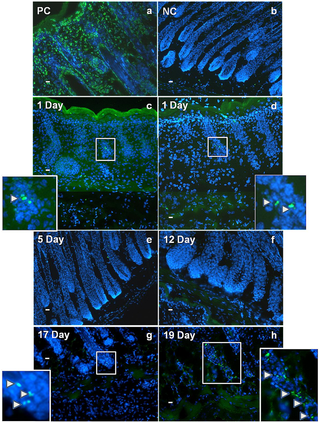
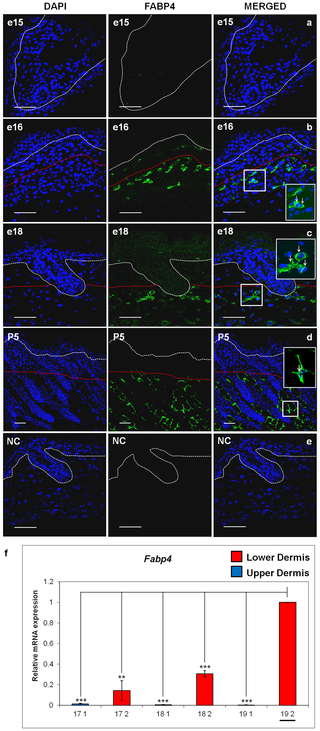
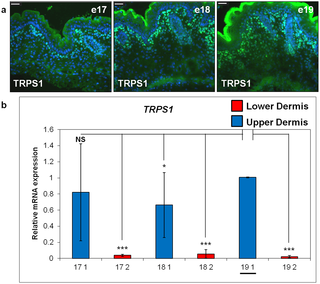
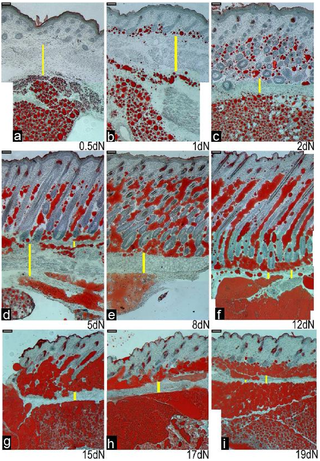
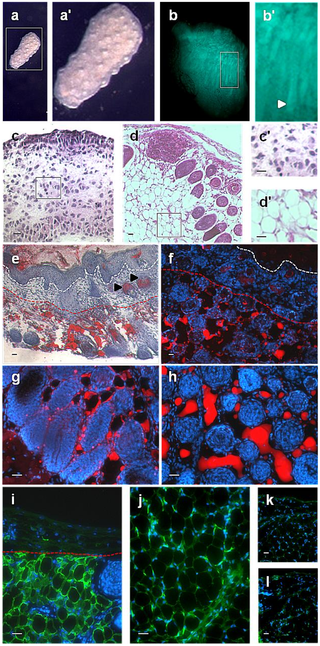
Development of the Mouse Dermal Adipose Layer […] Adipose Tissue and Is Marked by Restricted Early Expression of FABP4, 2013
レーザーマイクロダイセクション&プレッシャーカタパルト(LMPC):脳内リンタンパク質のウェスタンブロット検出
中枢神経系(CNS)は、複雑で特異的な解剖学的領域で構成されています。情報を受け取り、伝達する目的のため、互いに集まって相互作用しています。この情報は、脳内の特定のサブ領域で起こる選択的な生化学的変化によって特徴づけられます。これらの変化の多くは、キナーゼ活性とホスファターゼ活性のダイナミックなバランスに関わっています。神経細胞の適応、長期的な反応への移行、特定の行動を含む高次脳機能にはキナーゼとホスファターゼのバランスの微調整が不可欠です。いくつかの生物学的システムから得られたデータによると、脳の特定のサブ領域で細胞シグナル伝達のバランスが崩れると、行動障害につながることが示唆されています。そのため、特定の細胞群におけるタンパク質発現レベルやタンパク質活性のグローバルな変化を調べるためには、正確で強力な技術が必要になります。レーザーを用いたマイクロダイセクションは、より正確なプロテオミクスプロファイリングを可能にする方法として注目されています。本研究の目的は,特定の小脳領域におけるリンタンパク質の発現を特異的に検出するために、LMPC(Laser Microdissection and Pressure Catapulting)技術とイムノブロッティング法を組み合わせた方法論を開発することです。
Western blot detection of brain phosphoproteins after performing Laser Microdissection and Pressure Catapulting (LMPC), 2011
